Automated speech analysis to differentiate frontal and right anterior temporal lobe atrophy in frontotemporal dementia
Vonk, J. M. J., Morin, B. T., Pillai, J. […] García, A. M. […] & Gorno-Tempini, M. L. (2025). Automated speech analysis to differentiate frontal and right anterior temporal lobe atrophy in frontotemporal dementia. Neurology 104(9), e213556.
Antecedentes y objetivos: Antecedentes y objetivos: La demencia frontotemporal (DFT) incluye la variante conductual de la DFT (vcDFT) con atrofia frontal predominante y la variante conductual semántica de la DFT (vcsDFT) con atrofia predominante del lóbulo temporal anterior derecho (LTAd). Estas variantes presentan dificultades diagnósticas debido al solapamiento de los síntomas y la neuroanatomía. Una diferenciación precisa es crucial para la inclusión en ensayos clínicos dirigidos a proteinopatías TDP-43. Este estudio investigó si el análisis automatizado del habla puede distinguir entre la atrofia LTAd y la atrofia frontal relacionadas con la DF,T ofreciendo potencialmente una herramienta de diagnóstico no invasiva.
Métodos: Este estudio transversal utilizó datos del Memory and Aging Center de la Universidad de California en San Francisco. Mediante regresión logística escalonada y análisis de la curva receiver-operating characteristic, se analizaron 16 características lingüísticas y acústicas extraídas automáticamente de tareas de descripción de imágenes grabadas en audio. Se utilizó morfometría basada en vóxeles para investigar las relaciones cerebro-conducta.
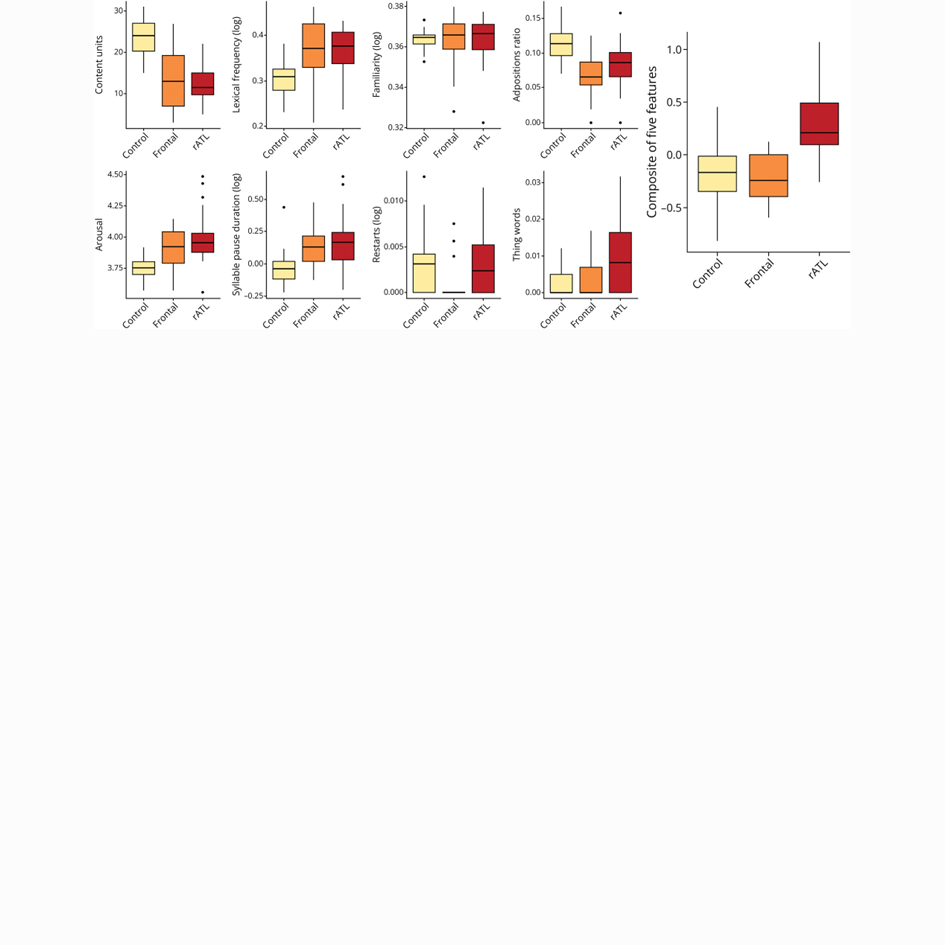
Resultados: Evaluamos a 62 participantes: 16 con atrofia frontal predominante relacionada con DFT, 24 con atrofia LTAd predominante y 22 controles sanos (edad media 68,3 años, SD = 9,2; 53,2% mujeres). La regresión logística identificó 3 características (unidades de contenido, frecuencia léxica y familiaridad) que diferenciaban al grupo general de DFT de los controles (área bajo la curva [AUC] = 0,973), ajustada por edad. Dentro del grupo DFT, 5 características (proporción de adposiciones/total de palabras, excitación, duración de la pausa silábica, reinicios y palabras que contienen «cosa») diferenciaron la atrofia frontal de la rATL (AUC = 0,943). Los análisis de neuroimagen mostraron que las características semánticas (frecuencia léxica, unidades de contenido y palabras que contenían «cosa») estaban vinculadas a las estructuras bilaterales del lóbulo temporal inferior, las características del habla y léxicas (duración de la pausa silábica y proporción de adposiciones/palabras totales) a los giros frontales inferiores bilaterales y las características socioemocionales (excitación) a áreas conocidas por mediar en la cognición social, incluyendo la ínsula derecha y las estructuras temporales anteriores bilaterales. Como puntuación compuesta, este conjunto de 5 características se asoció de forma única con la atrofia del LTAd.
Discusión: El análisis automatizado del habla demostró una gran precisión en la diferenciación de los subtipos de DFT y proporcionó información sobre la base neurológica de las alteraciones del lenguaje. El análisis automatizado del habla podría mejorar el diagnóstico precoz y el seguimiento de la DFT, ofreciendo una alternativa escalable y no invasiva a los métodos tradicionales, especialmente en entornos con recursos limitados. La investigación futura debería centrarse en la validación clínica adicional con otros biomarcadores de neuroimagen o fluidos y datos cognitivos longitudinales, así como en la validación externa en poblaciones más amplias y diversas.
Para acceder al artículo, hacé click aquí.
Automated speech analysis to differentiate frontal and right anterior temporal lobe atrophy in frontotemporal dementia
Vonk, J. M. J., Morin, B. T., Pillai, J. […] García, A. M. […] & Gorno-Tempini, M. L. (2025). Automated speech analysis to differentiate frontal and right anterior temporal lobe atrophy in frontotemporal dementia. Neurology 104(9), e213556.
Background and Objectives: Frontotemporal dementia (FTD) includes behavioral-variant FTD (bvFTD) with predominant frontal atrophy and semantic behavioral-variant FTD (sbvFTD) with predominant right anterior temporal lobe (rATL) atrophy. These variants present diagnostic challenges because of overlapping symptoms and neuroanatomy. Accurate differentiation is crucial for clinical trial inclusion targeting TDP-43 proteinopathies. This study investigated whether automated speech analysis can distinguish between FTD-related rATL and frontal atrophy, potentially offering a noninvasive diagnostic tool.
Methods: This cross-sectional study used data from the University of California, San Francisco Memory and Aging Center. Using stepwise logistic regression and receiver-operating characteristic curve analysis, we analyzed 16 linguistic and acoustic features that were extracted automatically from audio-recorded picture description tasks. Voxel-based morphometry was used to investigate brain-behavior relationships.
Results: We evaluated 62 participants: 16 with FTD-related predominant frontal atrophy, 24 with predominant rATL atrophy, and 22 healthy controls (mean age 68.3 years, SD = 9.2; 53.2% female). Logistic regression identified 3 features (content units, lexical frequency, and familiarity) differentiating the overall FTD group from controls (area under the curve [AUC] = 0.973), adjusted for age. Within the FTD group, 5 features (adpositions/total words ratio, arousal, syllable pause duration, restarts, and words containing “thing”) differentiated frontal from rATL atrophy (AUC = 0.943). Neuroimaging analyses showed that semantic features (lexical frequency, content units, and “thing” words) were linked to bilateral inferior temporal lobe structures, speech and lexical features (syllable pause duration, and adpositions/total words ratio) to bilateral inferior frontal gyri, and socioemotional features (arousal) to areas known to mediate social cognition including the right insula and bilateral anterior temporal structures. As a composite score, this set of 5 features was uniquely associated with rATL atrophy.
Discussion: Automated speech analysis demonstrated high accuracy in differentiating FTD subtypes and provided insights into the neural basis of language impairments. Automated speech analysis could enhance early diagnosis and monitoring of FTD, offering a scalable, noninvasive alternative to traditional methods, particularly in resource-limited settings. Future research should focus on further clinical validation with other neuroimaging or fluid biomarkers and longitudinal cognitive data, as well as external validation in larger and more diverse populations.
To access the full paper, please click here.